Uuringu algatamine Kliinikumis toimub vastavalt Kliinikumis kehtivale Kliinikumi korrale PKL-127.
Juhtiv uurija või üliõpilastöö (MV üliõpilane, doktorant, Tervishoiukõrgkooli üliõpilane) Kliinikumi poolne juhendaja vastutab uuringu läbiviimise eest Tartu Ülikooli Kliinikumi uuringukeskuses.
Uuringu algatamine Kliinikumis toimub uuringu sisse kandmisega DHS platvormil paiknevasse registrisse, mis on aluseks Kliinikumilt eetikakomiteele või Ravimiametile esitatava vastavalt asutuse nõusoleku või allkirjastatud Site suitability formsaamisele. Nõusolek Kliinikumilt uuringu teostamiseks antakse, kui registri väljad on nõuetekohaselt täidetud ning on saadud baaskliiniku ja kaasatud struktuuriüksuste registripõhised nõusolekud.
Registrisse peab esmaselt üles laadima järgmised dokumendid:
juhtiva uurija poolt allkirjastatud ravimiuuringu plaan
või
uurimistöö avaldus eetikakomiteele/uuringuplaan (akadeemilise uuringu puhul).
Kui uuring ei ole kantud kliinikumi registrisse, siis kliinikumi nõusolekut ei ole võimalik anda.
Palun saatke Riina Jannole
a) Ravimifirmade uuringute puhul juhtiva uurija poolt allkirjastatud uuringuplaan või eetikakomitee taotlus ja kliinikumi uurijate nimed, uuringu eeldatav algus-(algusvisiit) ja lõpukuupäev (sulgemisvisiit kliinikumis), maksimaalne uuritavate arv kliinikumis, kliinikumi kaasatud struktuuriüksused (apteek, radioloogiakliinik jt).
b) Akadeemiliste uuringute puhul projekti juhtiva uurija poolt allkirjastatud eetikakomitee taotlus.
Kui eetikakomitee taotluses ei sisaldu vastav info, siis ka kliinikumi uurijate nimed, maksimaalne uuritavate arv kliinikumis, kliinikumi kaasatud struktuuriüksused (apteek, radioloogiakliinik jt). Kui akadeemilise uuringu puhul on olemas uuringuplaan, siis palun saatke ka kliinikumi juhtiva uurija allkirjastatud uuringuplaan.
Riina Janno sisestab uuringu teadusuuringute registrisse ja palub registripõhiselt baaskliiniku ja kaasatud struktuuriüksuste nõusolekud uuringuga.
Vastavalt Kliinikumi juhatuse volikirjale 6. juuni 2023Nr 1.3-1/117 on Katrin Kaarna Kliinikumi juhatuse poolt volitatud isik Kliinikumi nimel alla kirjutama kliiniliste ravimiuuringute ja teaduslike uurimuste nõusoleku andmise dokumentidele ning asutuste ja osakondade vahelistele kliiniliste teadusuuringute raames toimuvatel koostöölepetele.
Kliinikumi kontaktisik räägib läbi kõigi kaasatud kliinikute ja struktuuriüksustega.
Riina Janno saadab Katrin Kaarna poolt allkirjastatud kliinikumi nõusoleku juhtivale uurijale ja/või kliinikumi kontaktisikule.
Ravimiuuuringute puhul allkirjastab Katrin Kaarna ka Site suitability form-i.
Juhul, kui uurimistööga kaasneb finantsleping Kliinikumiga, siis leping tuleb esmalt saata Katrin Kaarnale, Katrin.Kaarna@kliinikum.ee Palun saatke leping kohe, kui uuring on kantud kliinikumi teadusuuringute registrisse ja Teil on olemas lepingu esialgne versioon. Parandatud ja korrigeeritud versioon (juhul, kui see on vajalik) tuleb samuti esitada Katrin Kaarnale, kes läbi kliinikumi kantseleiteenistuse annab lõplikule lepingu versioonile DHSpõhise kinnituse. Lepingu allkirjastab Joel Starkopf. Lepingu allkirjastab enne uuringu sponsor ja seejärel Kliinikum.
Uuringutes vajalike (standardravist erinevaid) protseduuride ja analüüside eest ei tohi arvet esitada
Tervisekassale.
Täiendavad küsimused:
Riina Janno
Riina.Janno@kliinikum.ee
telefon 529 8508
Hea Kliinikumi patsient!
Kliinilised uuringud on osa teaduspõhisest meditsiinist. Teaduspõhine meditsiin ei ole dogmade komplekt, vaid areneb pidevalt edasi. Selle arengu mootoriteks on kliinilised uuringud ehk uuringud inimestel.
Kui Teid ravitakse Tartu Ülikooli Kliinikumis, siis on võimalik, et Teile pakutakse osalemist kliinilises uuringus.
Kliinilised uuringud jagunevad laias laastus kaheks – sekkuvad ja mittesekkuvad uuringud.
Mittesekkuvate uuringute puhul ei muudeta selles osalejate raviskeemi võrreldes tavapärase raviga, vaid kogutakse lisaandmeid haiguse kulgemise kohta. Mõnel juhul võib olla vajalik ka lisaanalüüside tegemine ja/või palutakse Teil täita küsimustikke. Mittesekkuvad uuringud on kooskõlastanud eetikakomitee.
Sekkuvad kliinilised uuringud hõlmavad haiguste ravi uute ravimite või ka ravimeetoditega. Nende puhul ei toimu Teie ravimine mitte ainult vastavalt Teie eelnevale tavapärasele ravile, vaid vastavalt kliinilise uuringu uuringuplaanile, mis tähendab, et Teie haigusele või mõnele Teie haigustest võidakse määrata lisaks tavapärasele ravile uus ravim või ravimid. Teatud haiguste või vigastuste puhul võidakse rakendada ka uusi ja täiendatud ravimeetodeid. Sekkuvad uuringud on kooskõlastanud eetikakomitee ja Ravimiamet, vajadusel Terviseamet.
Kui Teile pakutakse võimalust osaleda uuringus, siis lugege hoolikalt läbi osaleja infoleht. Esitage kõik oma küsimused uuringu läbiviijale enne teadva nõusoleku allkirjastamist. Kui allkirjastate teadva nõusoleku paberdokumendina, siis jääb selle üks eksemplar Teile. Hoidke seda palun alles, et vajadusel infoga uuesti tutvuda. Kui allkirjastate teadva nõusoleku digitaalselt, siis salvestage infoleht oma nutiseadmesse.
Teil on alati õigus uuringus osalemisest loobuda, Te ei pea seda põhjendama. Palun andke loobumisest teada oma uuringuarstile või -õele, kelle kontaktid leiate infolehest.
Teil on alati õigus pöörduda uuringut puudutavate küsimuste korral, millele Te vajate rohkem selgitust, Andmekaitse Inspektsiooni ning uuringu kooskõlastanud eetikakomitee poole. Ka need kontaktid on uuringu infolehes.
Kui pakutakse, et Teie laps osaleks kliinilises uuringus, siis kehtib kõik ülaltoodu. Alla 18-aastase lapse uuringus osalemise korral allkirjastab teadva nõusoleku lapsevanem, lisaks võimalusel ka laps. Laste puhul, kes on alla 7-aastased, püütakse neile arusaadavas keeles selgitada uuringus toimuvat. Lapsed vanuses 7-17 aastat allkirjastavad teadva nõusoleku vormi lisaks lapsevanemale pärast seda, kui neid on uuringust nõuetekohaselt teavitatud. Teie tunnete oma last kõige paremini, andke oma lapsele lisaselgitusi, et teada saada, kas laps on nõus uuringus osalema või mitte, vajadusel küsige lisainfot uuringu läbiviijatelt.
Värbamisfaasis kliinilised uuringud Eestis
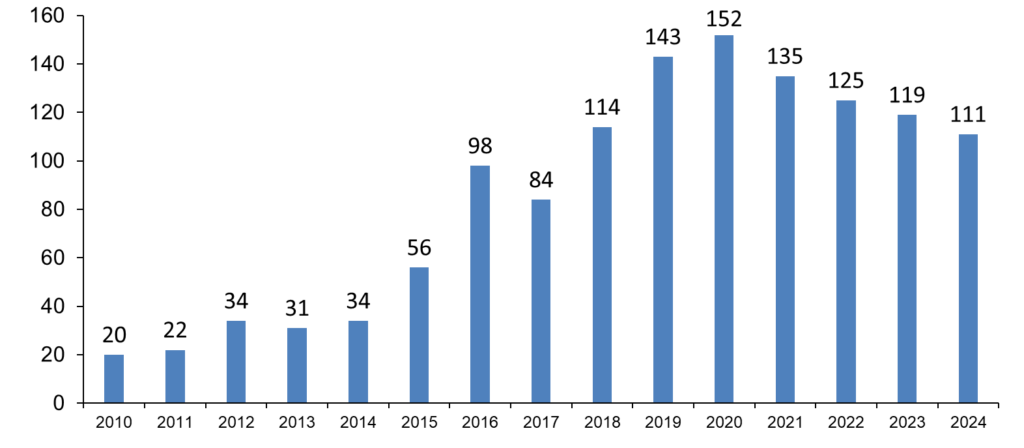
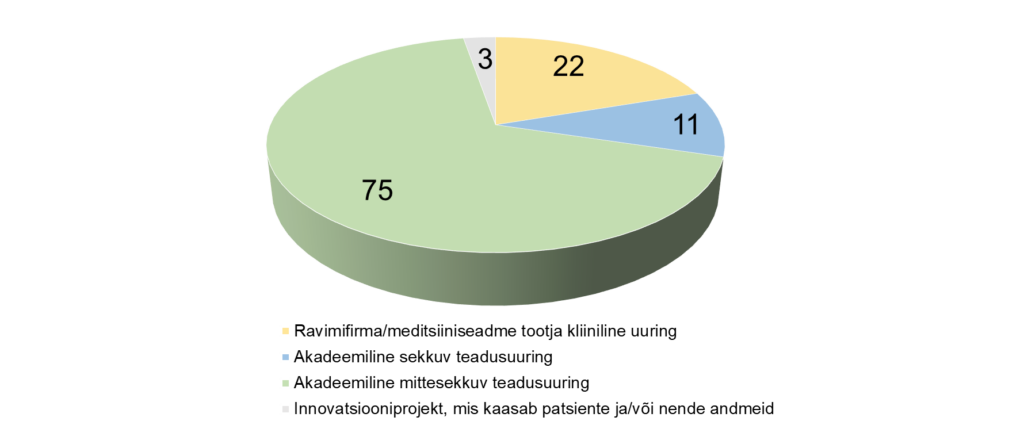
Tartu Ülikooli Kliinikumis algatatud teadusuuringud aastal 2024
Tartu Ülikooli Kliinikumis alustatud teadusuuringute arv aastate lõikes